Gタンパク質共役型受容体(GPCR)は創薬における最大のターゲットで、基礎研究・応用研究の両面から重要な分子です。GPCRをはじめとする受容体は、細胞外からの刺激を鋭敏に感知する一方シグナルの誤作動は極力避けるという、高感度と高精度の相反する性能を両立する必要があります。この仕組みを理解するために、私たちはGPCRの細胞内での運動を直接観察することで、作動機構の解明を試みました。
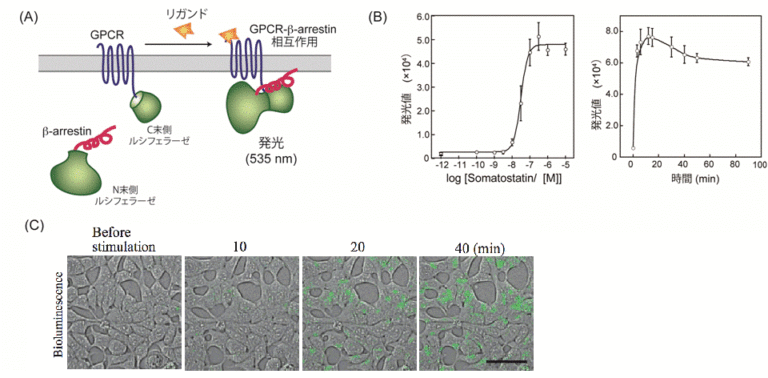
具体的には、GPCRの1つであるホルミルペプチド受容体1(FPR1)を発現している細胞に対してリガンドや阻害剤を添加して、添加した薬剤、FPR1、FPR1の下流分子であるGαを蛍光顕微鏡で観察しました。FPR1の細胞膜上での状態は、リガンド結合の有無と集合体形成の有無で、合計4つに分類することができます。このそれぞれの状態に対して、GαがFPR1に結合している時間を評価しました。すると、リガンドが結合しており、かつ集合体を形成している状態のみで、Gαの結合時間が有意に長くなりました。この結果から、FPR1はリガンド結合と集合体形成という2つの条件が揃うことで出力を発する、論理ゲートの一種である「ANDゲート」として機能することで、シグナル伝達を厳密に制御していることが示唆されました。この観察は、細胞膜上の個々のFPR1を、細胞を生かしたまま観察することで、リガンド結合の有無や集合状態について検出しました。生きた細胞で、FPR1・リガンド・Gαの3種類の分子を1つ1つ検出し、その運動や状態を解析したことで、FPR1の4つの状態それぞれに対してGαの結合時間を解析できました。生細胞内の3種類の分子を同時に、1分子1分子の動態を解析する技術は世界的にも非常に珍しい技術です。また、個々の受容体について活性の状態と活性化の機構が解明すれば、基礎研究としての意義はもちろん、創薬などにも有用な知見を与えることが期待できます。
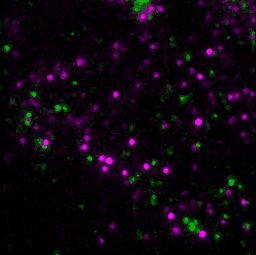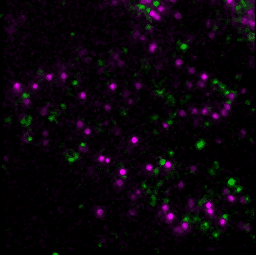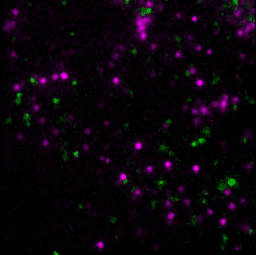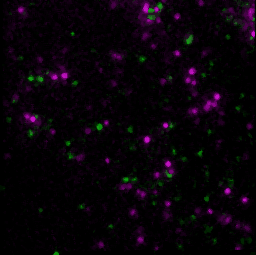
- T. Nishiguchi, H. Yoshimura, R. S. Kasai, T. K. Fujiwara, T. Ozawa, ACS Chemical Biology. 15, 2577–2587 (2020).
