生体内におけるタンパク質間の相互作用は生命活動を営む上で必須のイベントです。これまでの生化学的手法では特定時間におけるタンパク質間相互作用の記述しかできず、生体内で起こるタンパク質間相互作用の時間変化を追跡することは困難でした。近年では、GFPなどの蛍光タンパク質を利用した方法が開発されていますが、自家蛍光が強く透明度の低い動物個体を用いた場合、自家蛍光や光が個体深部まで届かないなどの問題により、タンパク質間相互用検出に十分なシグナルが得られないという欠点がありました。
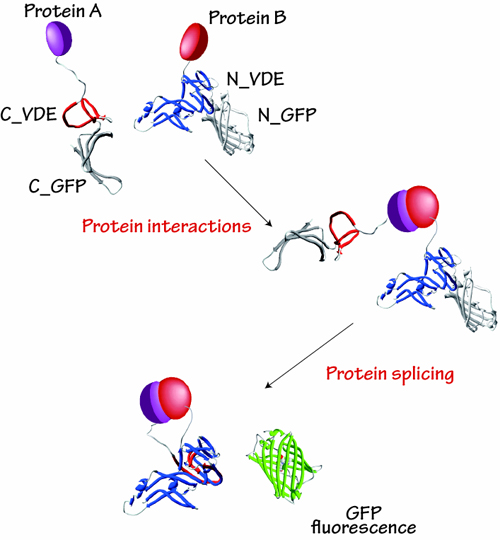
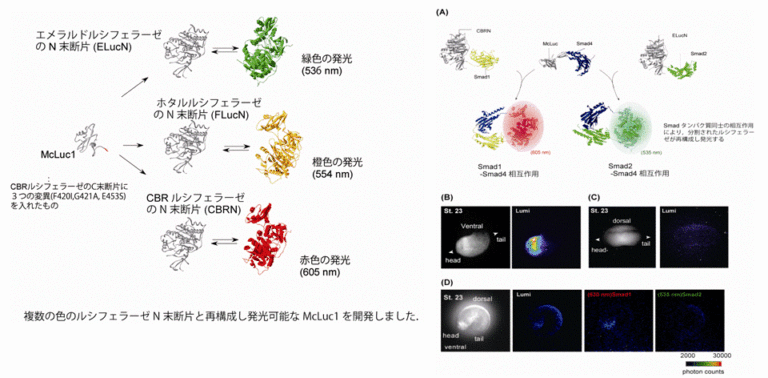
我々は、生物発光タンパク質(Luciferase: Luc)を用いたタンパク質間相互作用解析技術を開発しています。ホタル由来のLucを二分割すると酵素活性が失われます。しかし分割したLucのフラグメントを近接させると、Lucの酵素活性が回復して発光することを世界に先駆けて見出しました(1)。ホタルとは種の異なるルシフェラーゼを用いることで、緑、橙、赤色の発光を分離し、複数種類のタンパク質間相互作用のリアルタイムイメージングが可能となりました(2)。本方法により、自家蛍光が強く不透明な動物個体内のタンパク質間相互作用の高感度検出が実現しました。
開発した技術は、GPCR-βarrestin間相互作用(3)やSmads間相互作用など、細胞内シグナル伝達にくわえ、タンパク質の局在を可視化することが可能となり(4)、創薬研究への応用に展開しています。
- T. Ozawa, A. Kaihara, M. Sato, K. Tachihara and Y. Umezawa, Anal. Chem., 73, 2516-2521 (2001).
- N. Hida, M. Awais, M. Takeuchi, N. Ueno, M. Tashiro, T. Singh, M. Hayashi, K. Ohmiya and T. Ozawa, PLoS ONE, 4, e5868 (2009).
- H. Takakura, M. Hattori, M. Takeuchi and T. Ozawa, ACS Chem. Biol., 7, 901-910 (2012).
- S. B. Kim, T. Ozawa, S. Watanabe, Y. Umezawa, Proc. Natl. Acad. Sci. USA., 101, 11542-11547 (2004).
