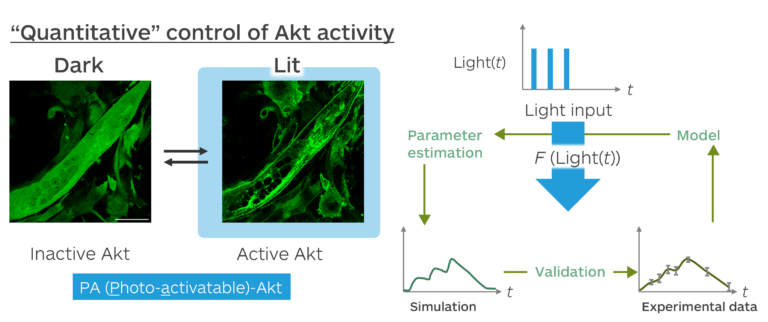
細胞内ではさまざまな分子の活性が体内時計や栄養摂取などに応じて適切な時間パターンで上昇・下降しています。例えば、細胞内シグナル伝達に関わるタンパク質リン酸化酵素Aktは糖尿病やガンといった疾患において、その活性が正常とは異なる時間パターンで上昇・下降することが知られています。このような分子の時間パターンがもつ生理的機能を解明するには、さまざまな時間パターンを自在に創り出すことのできる「定量的な分子活性の操作法」が必要です。そこで小澤研究室では、Aktの活性を意のままに操作するため、青色光照射依存的に相互作用する光受容タンパク質の対CRY2/CIB1を活用して光応答型分子PA-Aktを開発しました。
PA-AktではAktが細胞質から細胞膜への移行により活性化することに着目し、光照射依存的にAktを細胞膜に移行させることで、分単位の時間スケールでのAktの可逆的な活性化を実現しました。また、異なる強度やパターンで光照射した際のAktの活性化パターンを解析することで、任意の照射光に対して活性化されるAktの時間パターンをシミュレーションすることができる数理モデル(<Akt activity> = f[light(t)])を構築し、Akt活性を定量的に操作することに成功しました。この技術を用いることで、Akt活性の時間パターンの違いによって筋芽細胞内で遺伝子Atrogin-1発現の誘導強度が変化することを明らかにしました。
本研究で示した数理モデルを用いたシミュレーションによる分子活性の定量的な光操作法は、Akt以外の分子にも応用可能な汎用性があり、近年注目が集まっている「生命機能を光によって意のままに操り理解する」研究全般の発展に貢献することが期待できます。
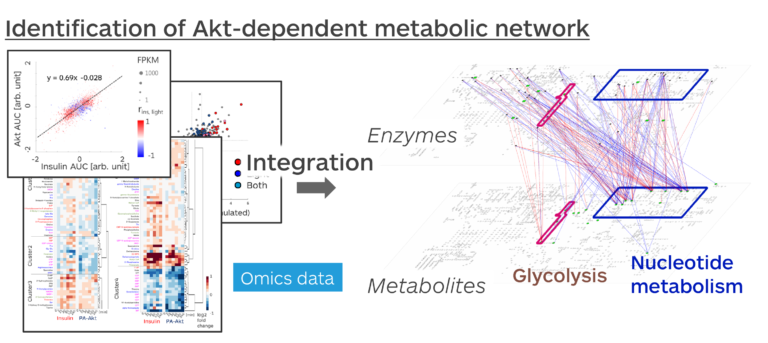
加えて, PA-AktがAkt選択的な活性化を誘導できることを利用し、細胞内代謝反応におけるAktの働きを詳らかにしました. 生体では血糖値を下げるホルモンであるインスリンの作用により代謝応答が細胞レベルで調節されています. インスリン作用により活性化される代謝反応はAktを含む酵素や代謝物など様々な分子により制御されているため, どの分子がどの程度代謝反応に寄与するのかを明らかにするためには数多の分子を網羅的に解析する必要があります. 本研究では光操作による分子選択的な活性化を, 網羅的測定データから分子ネットワークを同定するトランスオミクス解析と組み合わせた解析手法を開発することで骨格筋細胞の代謝におけるAktの働きの全体像を明らかにしました.
これら光操作の定量性を活用した数理モデルシミュレーションによる自在な分子活性の操作法や, 光操作の分子選択性を利用した特定の分子の機能を徹底的に解析する手法は多くの分子に応用可能な汎用性があり,近年注目が集まっている「生命機能を意のままに操り理解する」研究全般の発展に貢献することが期待できます.
- Y. Katsura, H. Kubota, K. Kunida, A. Kanno, S. Kuroda, T. Ozawa, Sci. Rep. 5, 14589 (2015).
- G. Kawamura, T. Kokaji, K. Kawata, Y. Sekine, Y. Suzuki, T. Soga, Y. Ueda, M. Endo, S. Kuroda, T. Ozawa. Optogenetic decoding of Akt2-regulated metabolic signaling pathways in skeletal muscle cells using transomics analysis. Sci. Signal. 16, eabn0782 (2023).
