近年RNAの細胞内局在や動態が細胞の様々な機能に関与しているとして注目されています。私たちはRNA結合タンパク質ドメインPUM-HDを利用し、任意のRNA 8塩基配列に対して選択的にタンパク質を結合させる技術を開発しました。
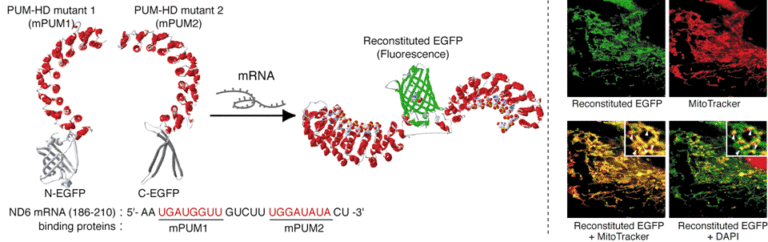
この技術と二分割蛍光タンパク質再構成法を利用して、標的RNAに結合すると光る、生細胞内で機能するRNAプローブを構築しました。これまで広く用いられてきたRNAプローブは細胞を化学固定する必要や、シグナル/バックグラウンド比が低い、または標的RNAに大きなタグ配列を融合する必要があるなど、様々な制限がありました。私たちが開発した技術では、プローブをコードした遺伝子ベクターの細胞への導入のみで、人為的に加工していない内在性RNAを標識・可視化できます。また、プローブ分子が標的RNAに結合して初めて蛍光性を回復するのでシグナル/バックグラウンド比も高く、蛍光1分子観察にも利用できます。開発したプローブ・標識技術は生細胞内の様々なRNAに適用できます。このプローブを用いて、これまでにミトコンドリア内に存在するNADH脱水素酵素のmRNA、細胞質に存在するβ-actin mRNA、核内に存在するテロメア反復配列含有RNA(TERRA)の観察を行ってきました。細胞内RNAの局在や輸送は細胞の遊走や発生・分化など様々な細胞機能発現と密接に関与しています。PUM-HDを用いたRNA標識可視化技術は多くの細胞生理機能の機構解明に寄与することが期待できます。

- Live Cell Imaging of Endogenous RNAs Using Pumilio Homology Domain Mutants: Principles and Applications., H. Yoshimura., Biochemistry, 57, 200-208 (2018). DOI: 10.1021/acs.biochem.7b00983
- T. Yamada, H. Yoshimura, R. Shimada, M. Hattori, M. Eguchi, T. K. Fujiwara, A. Kusumi, T. Ozawa, Sci. Rep. 6, 38910 (2016). DOI: 10.1038/srep38910
- H. Yoshimura, A. Inaguma, T. Yamada and T. Ozawa, ACS Chem. Biol., 7, 999-1005 (2012). DOI: 10.1021/cb200474a
- Visualization of non-engineered single mRNAs in living cells using genetically encoded fluorescent probes., T. Yamada, H. Yoshimura, A. Inaguma and T. Ozawa, Anal. Chem., 83, 5708-5714 (2011). DOI: 10.1021/ac2009405
- T. Ozawa, Y. Natori, M. Sato, Y. Umezawa, Nat. Methods. 4, 413–419 (2007). DOI:10.1038/nmeth1030
